介入式脑机接口,在阿尔茨海默病中的应用
阿尔茨海默病(AD)是一种进行性神经退行性疾病,也是老年人痴呆症的主要原因。其特征是突触功能障碍、神经元丢失和认知能力逐渐下降,通常导致独立生活能力的缓慢恶化。这伴随着认知功能的衰退和对他人的依赖性增加。AD的早期诊断仍然具有挑战性,因为认知能力和整体预后均随疾病进展而恶化,往往导致在晚期才确诊。
目前,AD的主要药物治疗包括胆碱酯酶抑制剂和NMDA受体拮抗剂美金刚。然而,这些治疗伴随着幻觉和头痛等副作用,且仅提供症状缓解,无法阻止疾病的不可逆进展。虽然近年来临床使用的抗Aβ单克隆抗体在针对AD病理机制延缓发病方面取得了良好效果,但这些药物价格昂贵,并不适合所有患者,且可能有潜在的长期副作用。
AD的理想干预措施应是早期诊断与早期治疗的结合。因此,迫切需要开发能够实现早期诊断并解决疾病潜在病理特征的替代疗法。脑机接口(BCI)技术代表了一种有前景的解决方案,为人类大脑与外部环境之间的直接交互提供了一种创新方法。该技术绕过外周神经,建立直接的通信和控制通路,允许大脑与外部设备之间进行双向信息传输。通过这种方式,可以操纵神经假体来恢复运动功能,或刺激特定大脑区域以抑制疾病表现(如癫痫)。
BCI通常根据植入深度分为侵入性、半侵入性和非侵入性,信号强度通常随植入深度的增加而增强。血管内脑机接口(EBCI)代表了侵入性BCI的一个亚型;然而,它不需要开颅手术。相反,它利用血管内技术将电极输送到目标脑区附近的血管中,以实现神经信号采集和其他功能。这种方法提供了与硬膜下电极阵列相当的信号采集性能,但其植入相关的创伤远小于传统的侵入性BCI。通过结合对特定脑区的精确靶向、高保真信号采集和微创性,EBCI非常符合AD患者的独特需求,因为这些患者特别容易受到组织损伤,且需要区域特异性的干预。
本综述重点介绍了EBCI的工作原理和功能能力,并评估了其在AD早期诊断和治疗中的可行性和安全性。
01
脑机接口 (BCI)
传统的BCI系统通过记录响应运动意图产生的神经信号,将其解码为数字形式,并利用神经反馈输出数字信号来控制神经假体。这些系统可以恢复运动功能或刺激特定脑区。
BCI主要分为三类:
侵入性BCI: 将电极直接植入皮层以收集神经信号。
半侵入性BCI: 如皮层电图(ECoG),位于颅骨内但不穿透皮层(硬膜外或硬膜下)。
非侵入性BCI: 使用外部传感器(如EEG、MEG或NIRS)捕捉信号,无需植入。
虽然非侵入性方法损伤最小,但信号质量因颅骨衰减和距离原因较差且不稳定。侵入性BCI(尤其是微电极阵列MEA)信号质量最好,但面临长期稳定性挑战,如血脑屏障破坏引发的炎症、胶质疤痕形成导致信号隔离等。简单增加通道数量并非临床可行的解决方案。
02
血管内脑机接口 (EBCI)
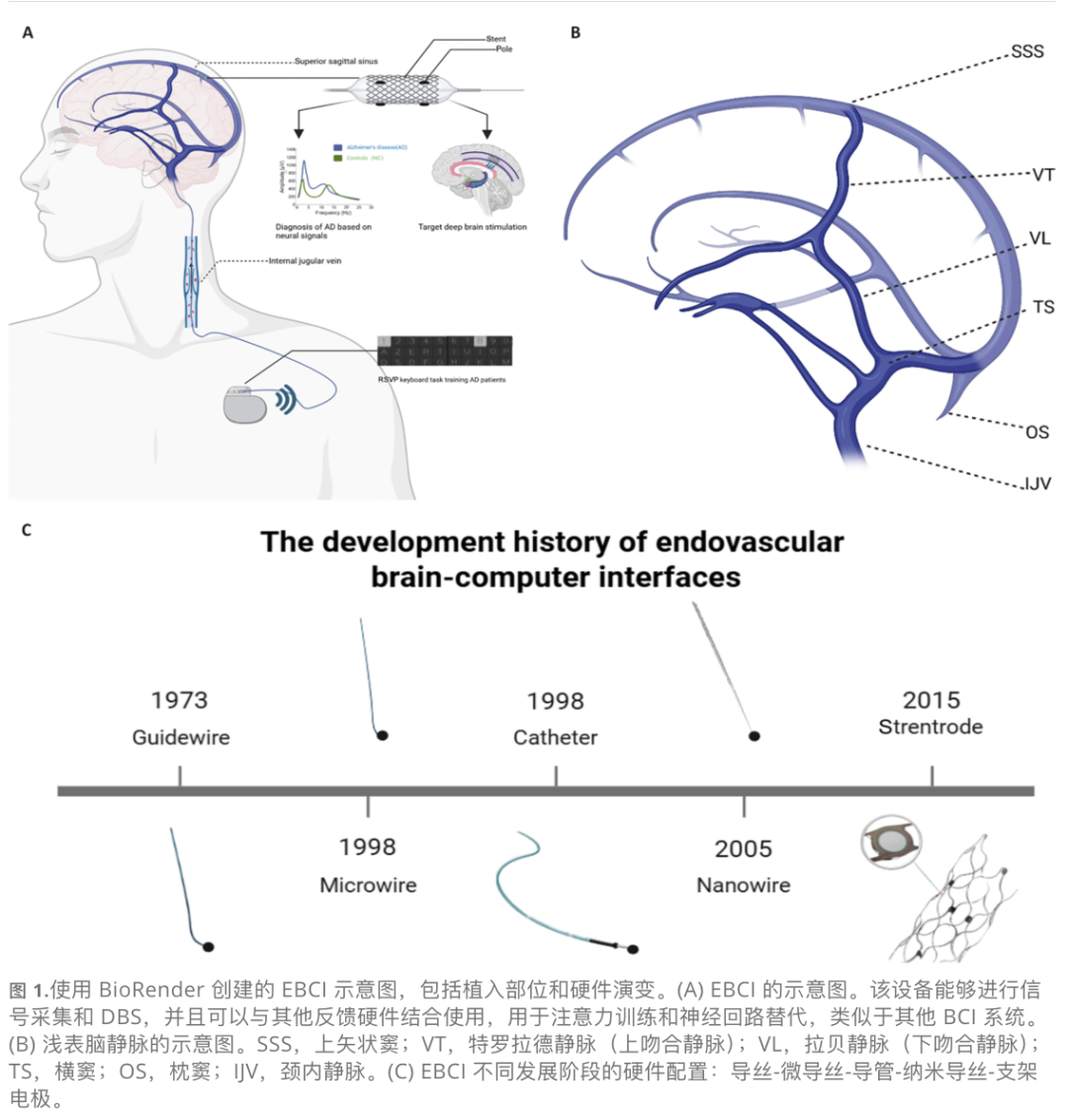
EBCI是一种有前景的技术,属于侵入性BCI的一种特殊形式。它提供稳定且高效的神经信号采集,同时最大限度地减少对患者的物理创伤。与需要开颅的MEA或ECoG不同,EBCI利用血管介入将电极输送至目标脑区附近的血管(图1A)。这种方法对预后不佳、无法进行开颅手术的老年患者特别有利。
相比传统侵入性BCI,EBCI通过血管内输送避免了与神经组织的直接接触,从而避免了慢性炎症导致的神经元退化和信号降解。相比半侵入性BCI,EBCI表现出优于硬膜外阵列的时空分辨率,且能安全有效地记录和刺激深部脑结构(如内侧颞叶和基底神经节),这对于皮层损伤导致信号丢失的病例特别有价值。此外,由于电极固定在血管结构内,机械故障(如移位)的风险大大降低。
发展历程:
1973年:导丝记录。
2016年:证明微电极可在血管内记录皮层信号。
2016年至今:支架电极(Stentrode)的突破,实现了长期植入。在羊模型中记录长达190天,支架被新生内膜覆盖,信号稳定。
2025年:Synchron宣布与Nvidia合作,结合AI平台提升解码速度;成功在ALS患者中植入并实现通过意念控制智能家居和在线购物。
临床数据:
在针对4名严重上肢瘫痪患者的先驱性人体临床试验中,EBCI植入一年后仍安全固定在上矢状窦内,未发生严重不良事件(如血管闭塞或血栓)。患者能够控制电脑进行发邮件、购物等操作。
03
AD患者作为应用目标
AD是一种网络断开障碍,受损的突触可塑性是其关键标志。未来的治疗主要分为两个方向:
靶向清除生化标志物(如Aβ和tau蛋白)。
增强神经连接以改善认知功能。
这两种方法都利用了BCI的潜力。理论上,通过电极阵列刺激特定脑区可以通过调节病理性的非线性连接模式来减少Aβ沉积,从而改善认知功能。DBS已被证明可以通过上调内源性神经营养因子、增强突触素表达和促进神经发生来发挥有益作用。
对于AD高危的老年人群,非侵入性BCI难以长期佩戴且刺激效果受限,而传统侵入性BCI带来的组织损伤和术后虚弱风险较高。EBCI的微创、恢复快和安全性高,非常符合AD患者的临床需求。
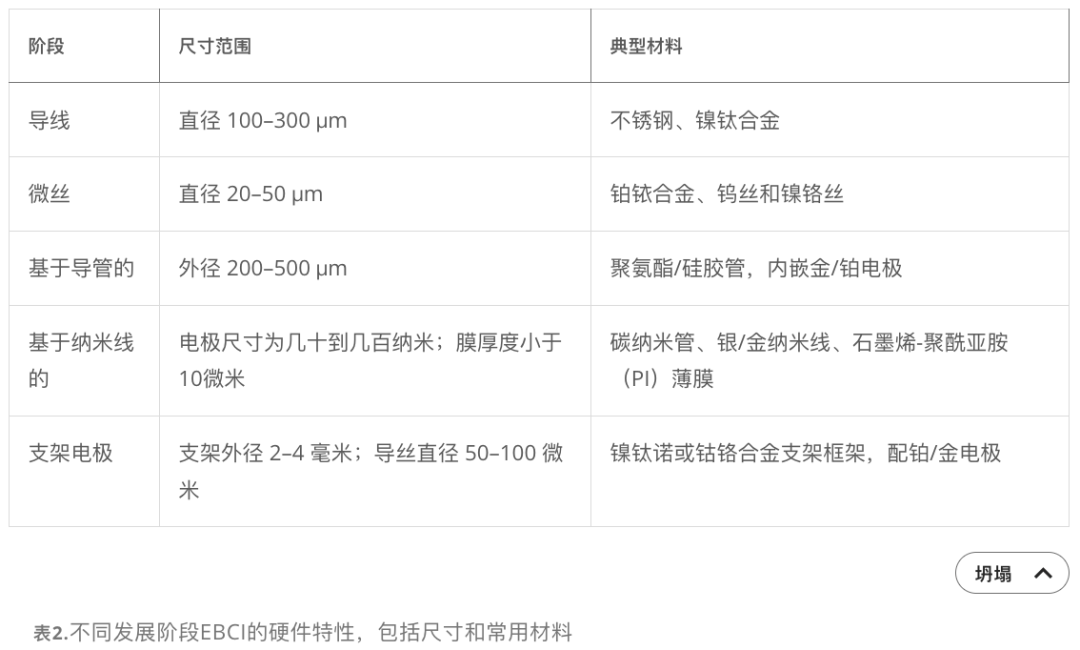
植入位点与安全性
目前大多数手术针对脑静脉窦。静脉植入相比动脉植入显著降低了血栓风险。特罗拉尔静脉(Vein of Trolard)是一个特别受关注的区域,位于中央沟后方,靠近感觉中心。
关于血栓风险,目前的人体研究采用术后3个月双重抗血小板治疗,随后12个月阿司匹林单药治疗,随访期间未报告血栓事件。虽然AD与脑淀粉样血管病(CAA)有共同的病理标志(Aβ沉积),增加了出血风险,但EBCI主要针对轻度AD患者,且使用更柔软的导丝和改进的技术可以进一步降低风险。
04
EBCI在AD早期诊断中的潜力
早期检测对AD至关重要。目前临床诊断依赖病史、量表和MRI,但在非典型症状患者中往往不可靠。生物标志物(如PET成像、脑脊液Aβ浓度)的发展推动了诊断标准的转变。
EEG生物标志物在分类MCI(轻度认知障碍)和AD方面准确率超过70%。AD患者的EEG特征包括:
频谱变化: 向低频节律转变(θ和δ波功率增加,α和β波功率减少)。
网络连接: 不同脑区间连接减弱,尤其是在中额叶和前额叶区域。
特定信号: P300潜伏期延长,稳态视觉诱发电位(SSVEP)幅度降低。
EBCI相比非侵入性EEG,具有便携设计和卓越的信号采集能力,可提供长期、高质量的信号记录,有望显著提高基于神经信号的AD诊断准确性。
05
EBCI在AD诊断和监测中的潜在作用
虽然EBCI尚不能作为AD早期诊断的通用工具(因需微创手术),但在特定人群中具有独特的补充价值:
无法进行CSF检查的疑似MCI患者: EBCI可进行1-3个月的电生理标志物动态监测。
接受抗Aβ抗体治疗的早期AD患者: EBCI可每月非侵入性地获取穹窿附近的信号,直接评估治疗的功能性疗效。
EBCI相比头皮EEG的优势:
消除监测盲点: 头皮EEG无法检测深部治疗靶点(如穹窿、海马通路)。EBCI电极可放置在距这些靶点1-2毫米处,直接记录局部场电位。
捕捉动态变化: 治疗反应通常是渐进的。头皮EEG只能提供快照,而EBCI植入后可进行连续的居家监测,捕捉功能性改善(如θ/α比率降低)。
解决“功能-病理分离”: 部分患者病理改善(PET显示Aβ减少)但认知未改善。EBCI可监测病理改善是否转化为神经回路的功能恢复。
06
EBCI在AD患者DBS治疗中的应用
深部脑刺激(DBS)通过向特定脑区发送电脉冲来调节异常脑活动。在AD中,刺激穹窿(Fornix) 显示出最显著的效果,可调节边缘系统活动,增加颞叶和顶叶的葡萄糖代谢,改善记忆功能。
虽然I期和II期临床试验验证了DBS的有效性,但其侵入性和高成本限制了广泛应用。EBCI作为一种微创替代方案,前景广阔。
EBCI用于DBS的可行性
解剖基础: 直径0.4-1.4毫米的大脑内静脉提供了通往丘脑、穹窿和前核的通路。
模拟验证: 羊模型研究表明,血管内支架电极刺激是可行的。计算机模拟显示,当刺激幅度低于5V时,血管内DBS对穹窿的激活效果与传统DBS相当。
精准度挑战: 电极位置偏差1毫米会导致目标激活减少1-10%。通过设计分段式电极并利用软件动态调整刺激配置(阴阳极配对和电流幅度),可以补偿物理位置偏差。
07
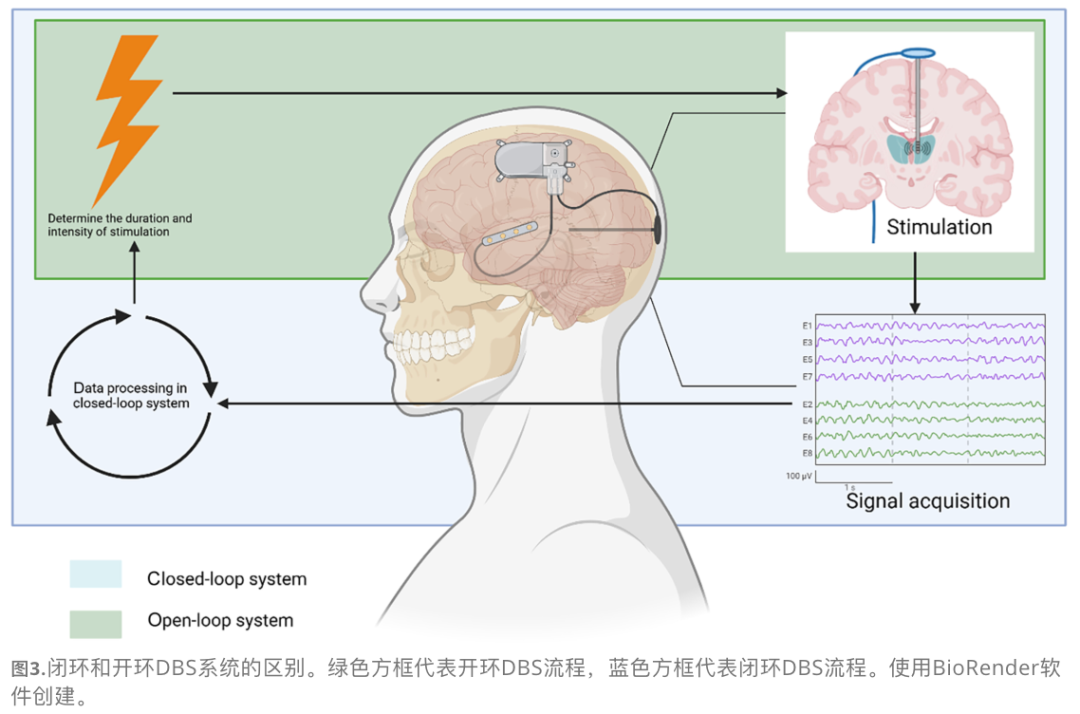
EBCI在AD治疗中闭环控制的作用
目前的DBS多为开环系统(参数预设固定),可能导致耐受性或无效。闭环系统根据实时脑活动调整刺激,对AD这种动态变化的疾病尤为重要。
生物标志物: 海马θ波活动、γ波和相位-振幅耦合(PAC)是闭环控制的有前景标志物。
优势: EBCI结合闭环系统,可提供更个性化、更精准的治疗,避免过度刺激或无效刺激。
08
EBCI在AD患者神经反馈训练中的应用
EBCI在ALS患者中已成功用于神经反馈(意念控制电脑)。然而,AD患者因认知下降,难以使用传统的BCI(如RSVP键盘)。
改进方案:
简单的EEG范式: 训练患者调节θ/α比率(降低θ或增加α),已被证明可改善认知功能。
个性化训练: 根据患者特定的EEG异常模式定制训练方案。
情感BCI: 对于严重认知障碍患者,利用条件反射和情感信号(如“哭/笑”对应“是/否”)实现基本交流。
结合fNIRS: EBCI结合功能性近红外光谱,可提高信号质量,增强神经反馈效果。
三合一治疗蓝图:
利用EBCI进行早期诊断 -> 确诊后进行低风险神经反馈训练(增强注意力和记忆) -> 对严重患者结合血管内DBS治疗(解决病理和症状)。
09
EBCI在AD康复中的应用前景
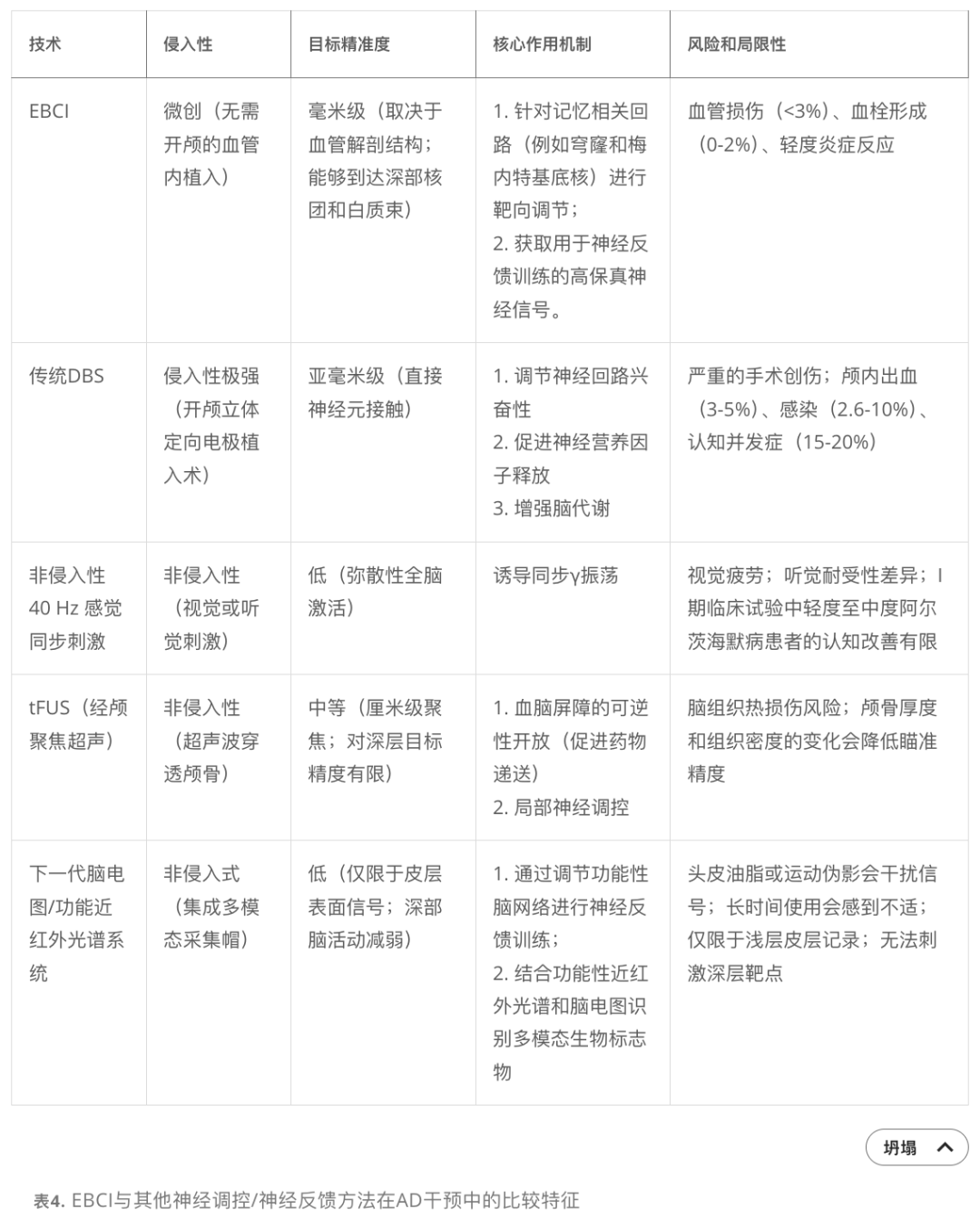
文章对比了EBCI与传统DBS、非侵入性刺激(40Hz)、聚焦超声(tFUS)和新一代EEG/fNIRS。
EBCI的核心优势:
微创: 避免开颅,降低手术风险。
精准: 可触及深部靶点(穹窿、基底核)。
多功能: 集诊断、DBS治疗和神经反馈于一体。
临床定位:
轻度AD患者的早期干预: 结合DBS和神经反馈,延缓进展。
不耐受传统DBS的患者: 提供微创替代方案。
中重度AD患者的长期闭环调节: 实时监测并动态调整治疗。
10
EBCI 的未来发展趋势与技术展望
1. 硬件系统的材料优化与电化学特性
支架材料与生物相容性: 目前的 EBCI 支架主要采用镍钛合金(Nitinol)制造 。该材料不仅具备超弹性(Superelasticity)以适应复杂的血管形态,其表面还能形成钝化的氧化钛涂层,有效防止腐蚀 。研究表明,经过表面改性的镍钛合金支架能显著减少镍离子的局部释放及炎症反应,从而维持长期的血管通畅性 。
电极阵列与抗阻优化: 支架搭载的电极通常由铂(Pt)或铂-钨(Pt-W)合金制成,并使用聚酰亚胺(Polyimide, PI)作为绝缘层以防止信号传输过程中的干扰 。为了进一步提高信号稳定性,植入前会采用循环伏安法(Cyclic Voltammetry, CV)清洁电极表面,这能有效降低电极阻抗(例如从 6.26 ± 6.7 kΩ 降至 2.21 ± 1.2 kΩ),从而显著提升信噪比 。
2. 长期植入的生理稳定性与“内皮化”进程
内皮化机制: EBCI 的长期稳定性依赖于内皮化(Endothelialization)过程,即血管内皮细胞逐渐覆盖电极表面 。
时间窗与信号演变: 这一过程通常经历两个阶段:
初始期(植入后约2周): 电极-组织界面发生动态变化,可能导致阻抗的相位偏移和信号质量的轻微波动 。
稳定期(植入后2-3周): 随着初步包裹完成,系统进入长期稳定记录状态 。
临床意义: 内皮化层不仅能有效降低血栓形成的风险,还能隔离血流产生的机械噪声,从而提高信号的稳定性 。然而,这种紧密的组织整合也使得设备的移除(Explantation)变得复杂,尽管短期(7天)移除已被证明安全,但长期移除的安全性仍需进一步验证 。
3. 器件微型化与高精度输送系统
解剖学限制与微型化目标: 目前的支架设计主要适配直径约 2.4 mm 的人脑静脉窦(如上矢状窦 SSS)。为了精准捕捉与 AD 相关的特定脑区信号(如中额叶),EBCI 必须向更细小的皮层静脉延伸 。目前的目标是开发能够进入 100 μm 级别微血管的超柔性微血管探针(Ultraflexible microvascular probes),如网状纳米线器件 。
智能导航技术: 为了在复杂的颅内血管网中精确输送这些微型设备,未来的介入手术将结合磁控导管技术(Magnetic steering)与血管内光学相干断层扫描(OCT)。OCT 可提供微米级的血管壁结构分辨率,结合 AI 图像分割算法,可实现从宏观路径规划到微观精准定位的导航 。
4. 全植入式无线化集成
现有瓶颈: 目前的 EBCI 系统仍依赖经皮导线连接至锁骨下窝的电子设备(如发射器)。这种物理连接存在感染(DBS 植入感染率约为 2.6%-10%)、皮下血肿及皮肤侵蚀的风险 。
技术愿景: 未来的核心突破在于将电子信号处理单元直接微型化并集成到血管内支架本体中。通过消除体内的长导线连接,实现完全的无线供电与数据传输,这将彻底改变 EBCI 的安全性配置,显著降低并发症发生率 。
5. 深部脑区网络的信息解析与调控
病理学需求: AD 是一种全脑网络疾病,伴随皮层和海马的显著萎缩,导致皮层信号可能出现稀疏化或冗余 。仅依赖皮层信号可能不足以进行精确的解码。
深部靶点触达: EBCI 具备独特的解剖学优势,可通过大脑前动脉或皮层下静脉系统,无创地接近基底节(Basal Ganglia)及迈内特基底核(Nucleus Basalis of Meynert, NBM)等深部关键核团 。
功能性闭环: 通过对这些深部记忆回路进行长期电生理监测和闭环电刺激(Closed-loop Stimulation),EBCI 有望在补充皮层信号缺失的同时,直接对受损的胆碱能通路进行神经调控,从而改善 AD 患者的认知功能 。
来源: https://spj.science.org/doi/10.34133/research.1049
本文2026-01-24 14:39:08发表“行业新闻”栏目。
本文链接:https://www.yixiuqixie.com/article/985.html