如果将人类大脑比作一块极其脆弱的豆腐,那么侵入式脑机接口(BCI)的历史,本质上就是人类试图往这块豆腐(大脑)里插入探测器,却拼命想保全豆腐(大脑)完整性的百年博弈。
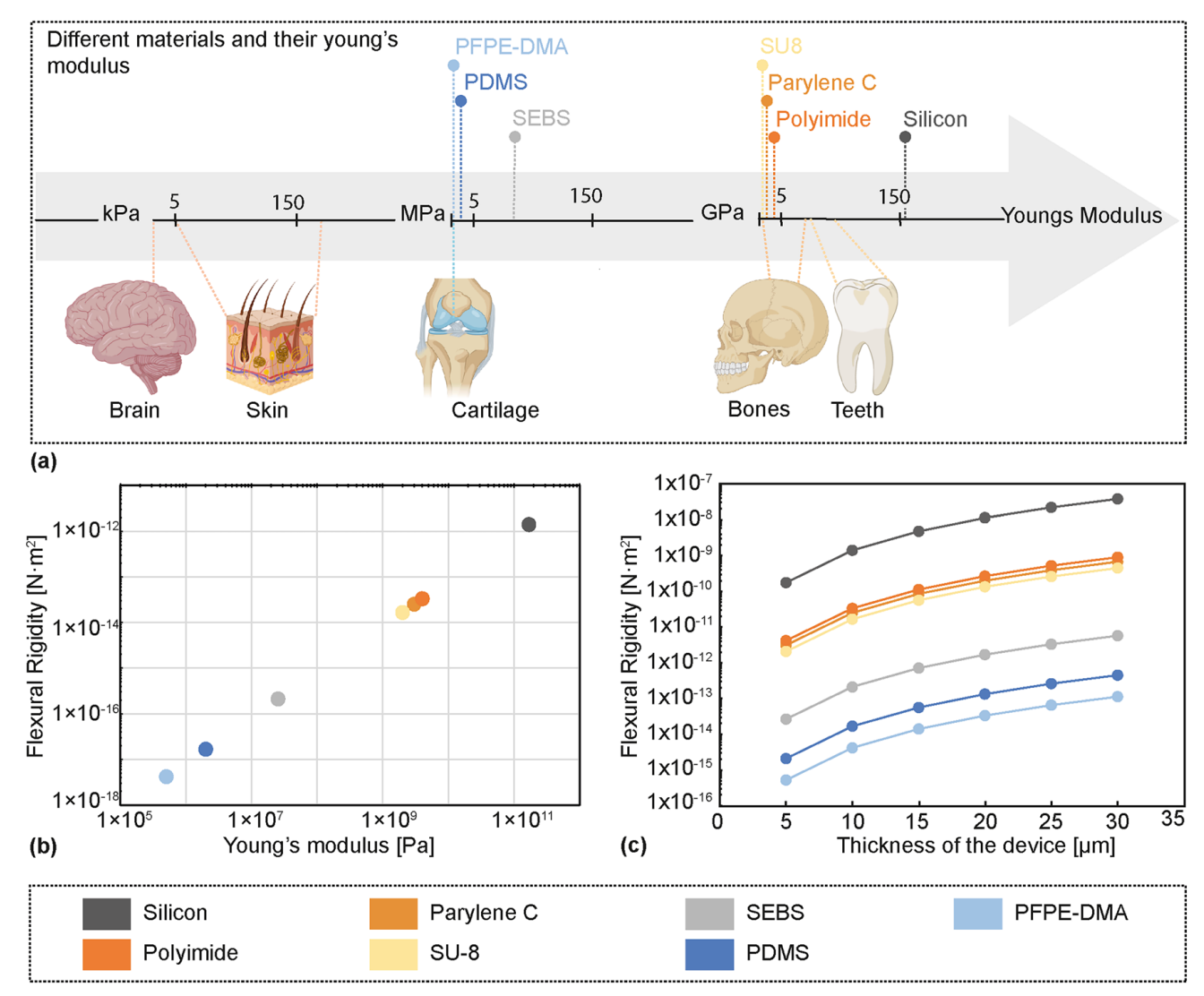
“大脑组织极软,弹性模量通常在 0.1–10 kPa 量级;传统电子材料如硅和金属的杨氏模量多在 50–200 GPa 量级。两者在刚度上相差约 10^7–10^9 倍,带来显著的软硬失配问题。”
图:神经探针常用材料的杨氏模量对比,以及杨氏模量与器件厚度对弯曲刚度的影响。
回顾过去半个世纪,脑机接口材料学经历了一场从“硬”到“软”,从“被动感知”到“主动智能”的革命。
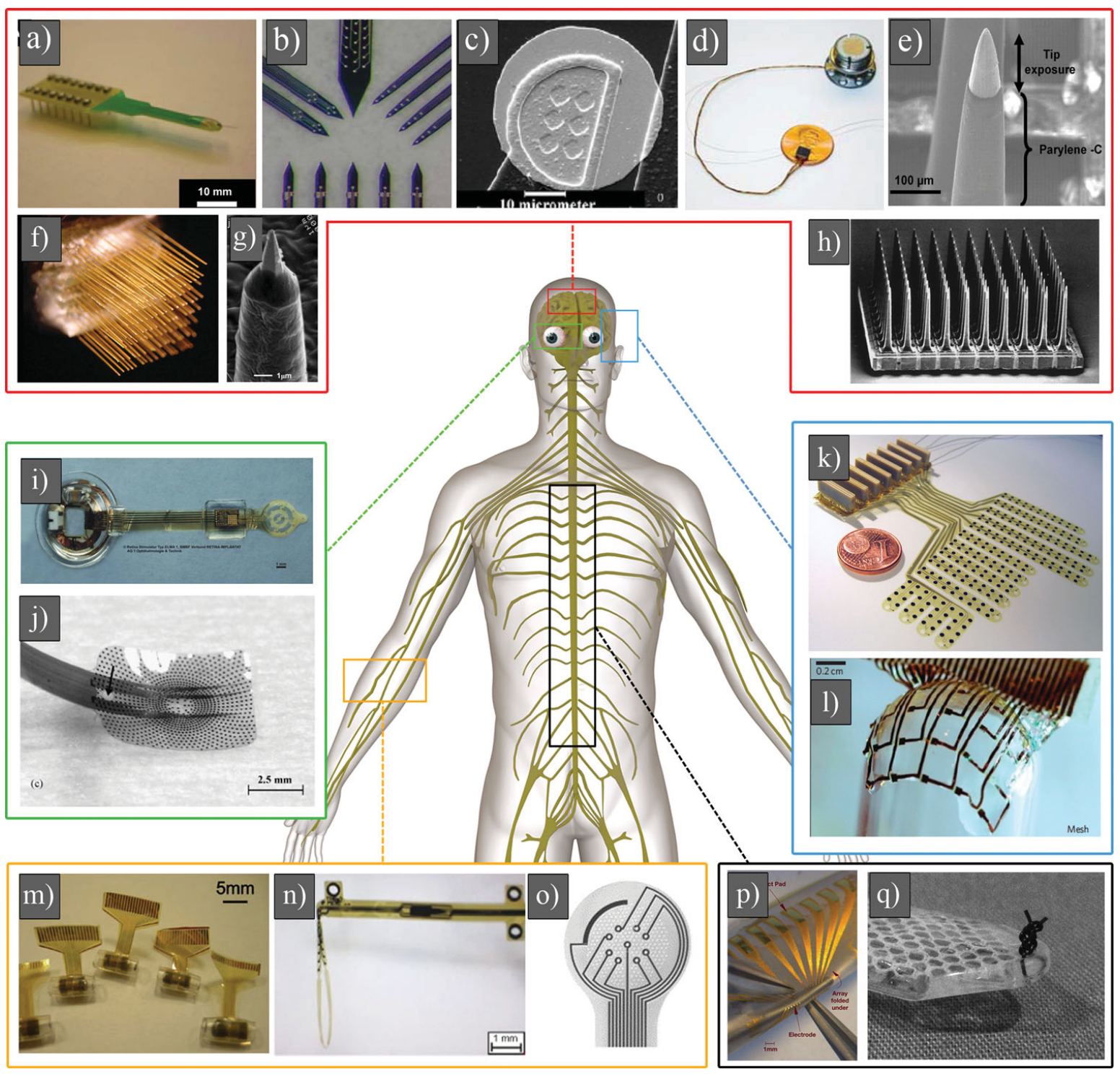
图:典型植入式电极/阵列形态示意。可以直观看到从硅基针状电极到柔性薄膜、网格等结构的演进。
回看脑机接口电极材料的历史:神经信号可以用电信号表征,那就用导电性可靠、工艺成熟的金属去把信号“引出来”。上世纪五六十年代到七十年代,钨丝、不锈钢、铂铱合金等材料成了主力。研究者常用电化学腐蚀或机械研磨把金属丝做成尖端微米级的微电极,再刺入脑组织记录放电。
这条路线奠定了现代神经电生理学的很多基础,单神经元放电、局部场电位、神经编码这些概念,都离不开当时的微电极记录。代价同样清晰:金属本体的弹性模量在几十到两百 GPa 量级,脑实质组织的弹性模量通常在 0.1–10 kPa 量级,测量方法不同会有浮动,但“软硬失配”这件事很难绕开,差异往往落在 10^7–10^9 倍这个量级。
更麻烦的点在于“相对位移”。脑组织会随呼吸、搏动、体位变化产生细微形变与位移。只要电极在颅骨端或连接端存在较强的机械锚定,电极与组织之间就会出现反复剪切。短期急性实验里,这种损伤可控;一旦进入慢性植入,插入损伤、微动剪切、炎症反应、界面阻抗变化会叠加,记录信号的稳定性很容易开始漂移。后来出现的可移动微驱动器、束状微丝等方案,确实能把慢性记录往前推进很多,但“长期稳定、可预测、可规模化”这道坎一直存在。
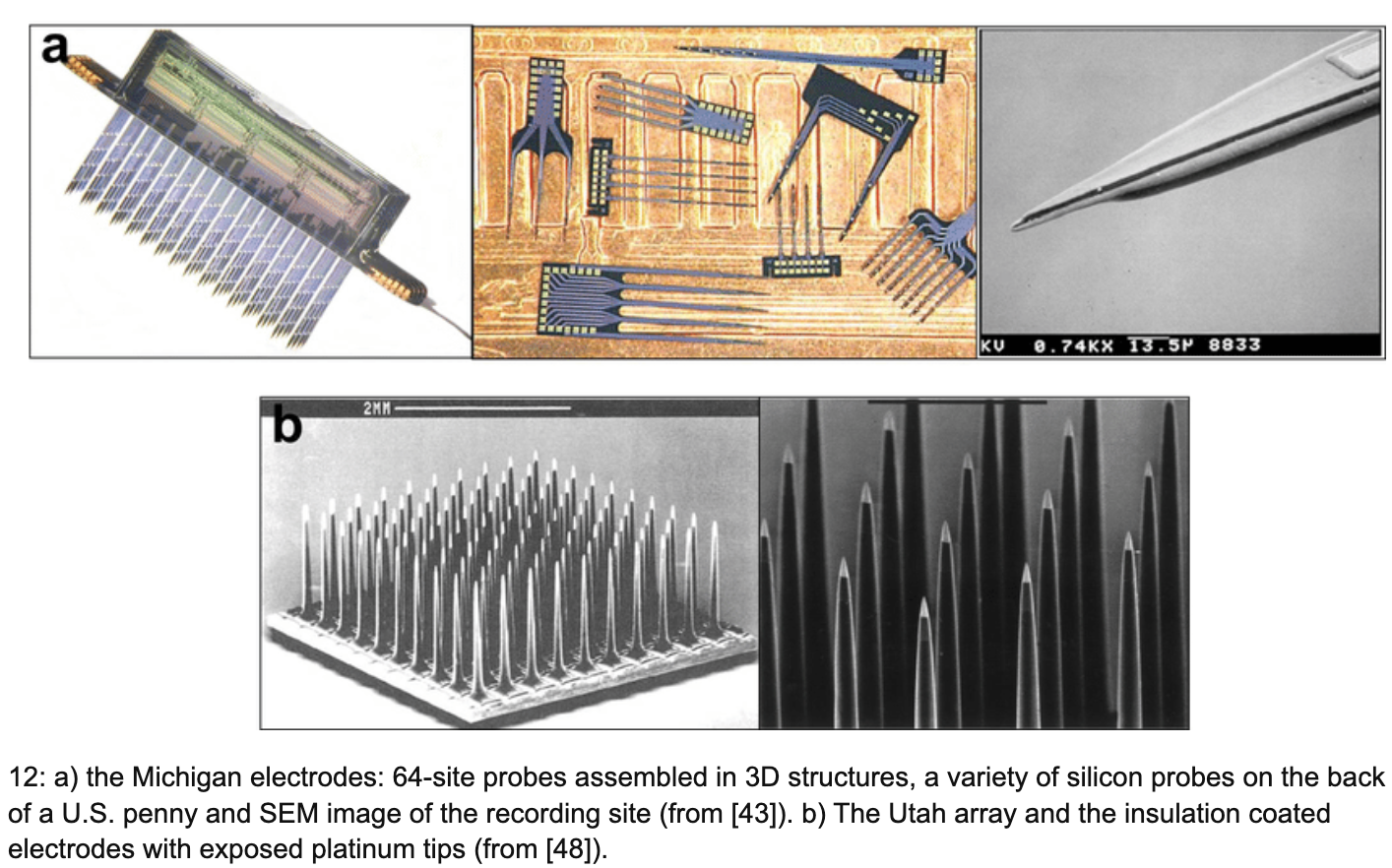
半导体工业带来的最大变化,是把电极从“手工尖针”带进了“可设计、可复制”的微加工体系。80 年代末到 90 年代,微加工硅探针快速成熟,典型代表包括密歇根探针(平面多通道探针)与犹他阵列(立体阵列)。它们把通道数、几何一致性、布线与封装形态,带到了一个过去很难想象的水平,神经记录从“单点”走向“阵列”,从“少量神经元”走向“神经元群体”。
硅的强项在于工艺与集成,弱项同样直接:硅的杨氏模量在百 GPa 量级,硬度与刚度都远高于脑组织。长期植入时,材料与组织的力学失配依旧存在。与此同时,硅探针更容易触发一条“慢性界面链条”:插入造成的血管与组织损伤、血脑屏障短暂破坏、蛋白吸附与细胞黏附、微胶质细胞激活与迁移、星形胶质细胞反应增强,最终在电极周围形成包裹与纤维化的组织反应。很多人把它笼统称为“胶质瘢痕”,更工程化的说法是“外来异物反应”导致的界面结构重塑。
这条链条带来的后果,往往体现在两个指标上:界面阻抗上升与可记录单元数下降。信号衰减通常在数周到数月出现波动并逐步恶化,个体差异很大,位置、血管分布、插入轨迹、固定方式、封装应力都会影响结果。也正因为差异大,产业化会更头疼:同一套器件、同一套手术流程,长期效果很难做到像心脏起搏器那样“可预期”。
进入 2010 年代,CMOS 工艺与神经探针结合进一步放大了通道规模,学术界出现了更高通量的硅基方案,信号采集能力不断上台阶。与此同时,界面反应与封装可靠性依旧像一根绳子,把性能上限拽住。高通量越往上堆,越会逼迫材料与封装把“长期稳定”这道题答出来。
当基底材料短期内很难彻底摆脱高刚度时,研究者把突破口放在电极表面与界面电化学上。一个很现实的事情是,记录与刺激真正发生在电极触点与组织接触的那一小块区域,电极体材料只负责支撑与连线。触点做得好,至少可以把“电学界面”这部分问题先压下去。
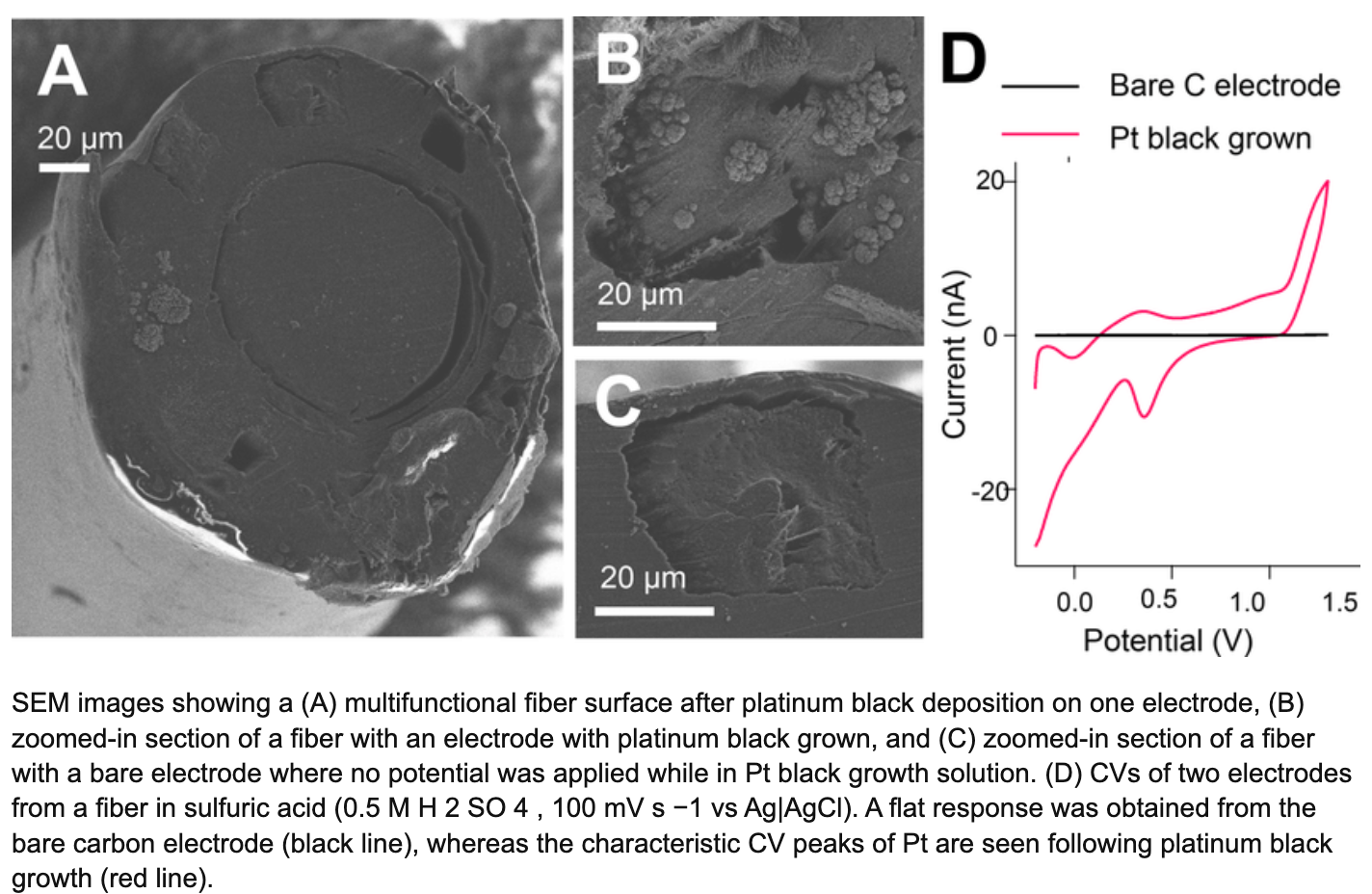
典型路线包括贵金属粗化与氧化物涂层(如铂黑、氧化铱、氮化钛等),以及导电聚合物与碳材料涂层(如 PEDOT:PSS、碳纳米管、石墨烯等)。这些涂层的共同目标是:增大有效表面积,降低界面阻抗,提高电荷注入能力,扩大安全电化学窗口,从而提升记录信噪比与刺激效率。微纳形貌与表面能的变化,也会影响蛋白吸附与细胞黏附行为,进而对慢性炎症反应产生影响。
这条路线在工程上似乎很“划算”,原因在于它能在不大改器件结构的前提下,显著改善关键电学指标。但它也有自己的坑:涂层的附着力、疲劳剥离、体液环境下的化学稳定性、反复刺激下的形变与溶胀,都可能让“短期漂亮数据”在长期里打折扣。很多团队在这一段吃过亏,实验室阶段看起来很惊艳,上动物慢性后,性能衰减的原因反倒来自涂层本身。
真正把范式往前推的,是柔性电子与软材料体系的成熟。聚酰亚胺、Parylene C、SU-8、PDMS 等聚合物材料进入神经界面后,电极形态从“针”逐步走向“薄膜”“带状”“线状”。对植入式电极来说,决定“软硬感受”的关键指标往往不是材料的杨氏模量单点值,而是结构的弯曲刚度。弯曲刚度随厚度呈立方关系变化,厚度降一个数量级,弯曲刚度会出现几个数量级的下降。超薄柔性电极能显著减少相对剪切应力,让器件更顺应组织微动,这是很多柔性路线能在慢性表现上赢一截的原因。
柔性路线也带来新的工程难题:柔软意味着更容易屈曲,插入时可能“顶不进去”。因此你会看到大量“插入辅助”设计:临时刚性支撑、可溶解涂层、插入导针、可降解穿刺层、磁控或气动辅助等。还有一个经常被忽略的点是“固定与引线”。电极再软,若在颅骨端固定方式过硬、引线应力管理不好,微动剪切依旧会回到界面上,长期稳定性仍会被拖累。
产业界里, Neuralink属于柔性线状电极的高曝光代表。它把超细电极线、机器人插入、通道规模与系统集成打包推进,它目标是:在更高通量下把组织损伤与慢性失配压到更低。外界常用“比头发丝还细”去形容这类电极线,传播上很有效;更关键的技术点在于降低弯曲刚度、控制插入损伤、管理封装与固定应力。长期表现最终要回到材料、结构、封装与手术流程的全链条耦合上,单靠“更细更软”还不够。
5、血管内路线:把损伤从“开颅穿刺”转移到“血管驻留”
另一条很有产业意味的路径,是把“进入大脑”这件事换一种方式完成。 Synchron推进的血管内电极属于典型案例,核心器件是基于镍钛记忆合金的支架样结构,通过血管路径抵达目标区域附近完成信号采集。它能避开开颅与皮层穿刺,对手术可及性与患者接受度有现实意义。
这条路线当然也有对应的代价,就是风险从“脑组织穿刺损伤”转向“血管路径与支架长期驻留”的问题,包括血栓风险、内膜反应、抗凝管理等;信号层级也会更接近皮层表面场电位,与皮层内微电极记录到的单神经元放电属于不同档位。换句话说,它把一部分生物力学与手术风险换成了血管介入体系下更熟悉的工程与临床管理逻辑,同时也接受了信号形态与分辨率的边界。
6、2025 与未来:朝向组织样电子学、抗污染界面与长期可靠封装
站在 2025 这个节点再看“下一步”,行业里出现的关键词正在从“更导电”转向“更像组织”。水凝胶、导电水凝胶、离子导体、复合弹性体等材料体系受到关注,一个核心方向是把材料模量调到 kPa 量级,让电极在力学上更接近脑组织。很多概念会强调“隐形”“融合”,更稳的表达是“把界面剪切应力与慢性炎症反应压低到可控区间”,让长期信号更稳定。
另一个被反复验证的方向,是抗污染与低炎症界面。蛋白吸附、细胞黏附与慢性炎症之间存在非常强的耦合关系,两性离子材料、亲水刷层、抗黏附涂层等方案的价值在于减少非特异吸附,让界面不那么容易被“封死”。这类材料很多时候不会给你立竿见影的“信号翻倍”,但它可能决定 6 个月、12 个月之后信号还在不在。
更进一步的概念包括“网状电子学”“注射式电子学”等超柔性结构。哈佛大学Charles Lieber等团队提出并推进的网状思路,本质上在追一种结构级的顺应性:器件像一张网,留出足够的空间让细胞与组织结构穿行与生长,让界面从“硬隔离”走向“结构互嵌”。这条路线的挑战集中在可控展开、定位、长期封装与量产工艺上,离大规模临床产品还有不少工程要补,但它把“生物融合”从口号变成了结构设计问题。
“自修复材料”与“可降解材料”也在逐步进入神经界面语境。自修复弹性体与导电网络的研究,已经能在实验条件下实现一定程度的微裂纹修复或导电路径恢复。现实产品层面需要回答更多问题:修复触发条件、体内环境下的修复效率、修复后电化学安全性、长期疲劳循环后的可靠性。可降解材料则更适合短期监测或过渡性治疗场景,优势在于减少二次取出手术的需求,难点在于降解过程对界面电学性能的影响与安全边界的定义。
回头看会发现材料只是表面,真正的主线是“长期神经界面”。早期靠金属把信号拿出来,中期靠硅把通道堆上去,后期靠涂层把电学指标压下去,再往后靠柔性与软材料把力学失配降到更低。
参考文献
Fattahi, P., et al. (2014).A Review of Organic and Inorganic Biomaterials for Neural Interfaces. Advanced Materials.
Wu, N., et al. (2021).