近3000万高血压的“真凶”:为何原醛症,总在“躲猫猫”?
文章来源:医休观心
大家好,我是医休哥。今天,我们来聊一个既熟悉又陌生的话题——高血压。但我们不谈常规的“原发性高血压”,而是要揪出一个隐藏在其中的“幕后黑手”——原发性醛固酮增多症,简称“原醛症”(PA)。 您可能不知道,原醛症是继发性高血压中最常见的病因,但它在临床实践中却面临着惊人的漏诊和误诊率。这就像一个在人群中作案的头号嫌犯,我们明明知道他就在那里,却总是抓不住他。为什么会这样?
一、 冰山之下:被严重低估的“高血压元凶”
在过去,原醛症被认为是罕见病,患病率不足高血压人群的1% 。然而,随着诊断技术的进步,尤其是醛固酮肾素比值(ARR)筛查的普及,这座冰山逐渐浮出水面。 最新的流行病学数据显示,原醛症的实际患病率远超想象。在普通高血压患者中,其患病率估计在5%至15%之间 ;在中国,社区新发高血压人群中的检出率约为4%,住院患者中则高达10.7%。而在那些服用了三种或以上降压药血压仍不达标的“难治性高血压”患者中,原醛症的患病率更是飙升至17%-23%。一项覆盖中国11个省19个中心的研究显示,难治性高血压患者中原醛症患病率为7.1%。 根据这些数据粗略估算,中国近3亿高血压患者中,可能潜藏着近3000万原醛症患者,这是一个触目惊心的数字。然而,与之形成鲜明对比的是,全球范围内,仅有不到2%的符合筛查条件的患者真正接受了筛查。这意味着,绝大多数原醛症患者被错误地归入了“原发性高血压”的大军中,接受着效果不佳甚至错误的治疗,长期暴露于醛固酮毒性带来的心、脑、肾靶器官损害的巨大风险之下 。 为何患病率如此之高,诊断率却如此之低?这背后,是一条充满挑战与误区的诊断之路。
二、 迷雾重重的诊断之路:原醛症为何难以“现形”?
原醛症的诊断流程通常分为四步:初步怀疑、筛查试验、确诊试验和分型诊断。然而,每一步都暗藏玄机,共同导致了其高误诊、漏诊率。 第一关:临床警惕性不足——“伪装”的初步胜利 原醛症的第一个“伪装”,就是其非特异性的临床表现。 传统教科书上将“高血压合并低钾血症”奉为原醛症的经典表现 。这使得许多基层医生形成了一种思维定式:没有低血钾,就不是原醛症。然而,大量的临床研究早已颠覆了这一认知,事实上,超过一半甚至更高比例的原醛症患者,其血钾水平是完全正常的。如果仅仅依赖低血钾作为筛查线索,将至少漏掉一半的患者。 此外,原醛症的其他症状,如头晕、乏力、肌肉无力、周期性麻痹、夜尿增多等 也缺乏特异性,极易与其他疾病混淆,或被归因于高血压本身。患者的血压水平也可能从轻度到重度不等 并非都是难以控制的重度高血压。这种“平平无奇”的临床面貌,使得医生在面对一个普通的高血压患者时,很难第一时间联想到原醛症的可能性,从而错过了启动筛查的最佳时机 。

第二关:筛查的“阿喀琉斯之踵”——复杂的ARR检测 醛固酮-肾素比值(ARR)是目前公认的首选筛查方法。然而,这个看似简单的比值,在实际应用中却极其“娇贵”,是导致错诊、漏诊最关键的环节之一。 1. 药物干扰的“无间道” ARR的准确性极易受到各种降压药物的干扰,这些药物就像“内鬼”,会让检测结果出现假阳性或假阴性。
导致假阳性(ARR升高)的药物: β受体阻滞剂(如美托洛尔)、中枢α2受体激动剂(如可乐定)等,它们会抑制肾素的分泌,导致肾素水平被人为压低,从而使ARR比值假性升高 。有研究的统计分析显示,使用β受体阻滞剂与ARR阳性结果显著相关(p=0.004)。 导致假阴性(ARR降低)的药物: 这是更常见、更隐蔽的问题。利尿剂(尤其是排钾利尿剂如氢氯噻嗪)、ACEI(普利类)、ARB(沙坦类)、盐皮质激素受体拮抗剂(MRA,如螺内酯)等药物,会刺激肾素分泌,导致肾素水平升高,从而使ARR比值假性降低,造成漏诊。
为了排除这些干扰,包括《2024年中国高血压学会指南》在内的国内外指南均建议,在进行ARR筛查前,需要停用相关药物2-4周,甚至更长时间 。但在临床实践中,让一个中重度高血压患者停用所有主力降压药数周,面临着巨大的血压失控风险,操作难度极大,依从性也差。这就形成了一个两难困境:不停药,结果不准;停药,风险太高。很多医生因此放弃筛查,或者在带药情况下检测,并因结果阴性而错误地排除了原醛症。 2. 诊断阈值的“标准之争” 即便严格停药,ARR的诊断阈值也并非全球统一。由于检测方法(肾素活性 vs. 肾素浓度)、单位、实验室条件等差异,不同中心和指南推荐的ARR切点各不相同。例如,《2024年中国高血压学会指南》中提及,基于肾素活性的ARR切点通常为 >30,而基于肾素浓度的切点则为 >3.7 。这种标准的不统一,无疑增加了临床判读的复杂性,可能导致部分处于临界值的患者被漏诊。 3. 其他生理因素的干扰 除了药物,患者的血钾状态、钠盐摄入量、体位、年龄、肾功能,甚至女性的月经周期,都会影响ARR的数值 。这些复杂的变量,都要求检测过程高度标准化,但在繁忙的日常门诊中,很难做到万无一失。

第三关:影像学的“迷魂阵”——“眼见”不一定为实当ARR筛查阳性并通过确诊试验(如盐水负荷试验)后,就需要进行分型诊断,即区分是单侧的醛固酮瘤(APA),还是双侧肾上腺增生(IHA),因为二者的治疗方案截然不同(前者首选手术,后者首选药物)。肾上腺CT或MRI是首选的影像学检查,但它们也常常布下“迷魂阵”。 1. “无功能”的偶发瘤(假阳性) 随着影像技术分辨率的提高,在普通人群中发现肾上腺小结节(偶发瘤)的概率越来越高。然而,这些结节绝大多数是无内分泌功能的“良民”,并不会分泌过多的醛固酮。如果一个原醛症患者恰好是双侧增生,但CT又碰巧发现了一个无功能的偶发瘤,医生很可能被影像报告误导,错误地判断为单侧腺瘤,从而对患者进行了不必要的手术。 2. “隐形”的微腺瘤(假阴性) CT对小于1cm的微腺瘤非常不敏感 。许多分泌功能活跃的醛固酮瘤,因为体积太小,在CT上可能完全“隐形”,导致影像报告为“双侧肾上腺未见异常”。这会使医生错误地判断为双侧增生,从而让一个本可以手术治愈的患者错失了机会,只能终身服药。 3. 一致性差的尴尬 影像学检查看的是“形态”,而原醛症的本质是“功能”异常。形态与功能的不匹配是导致误判的根源。一项包含38项研究、950例患者的系统回顾分析显示,CT/MRI与功能性金标准(AVS)的结果一致率仅为62.2%。这意味着,近四成的影像判断可能是错误的。仅依赖CT/MRI,可能导致18.5%的患者接受了不恰当的手术,同时让19.1%本应手术的患者未能得到根治。

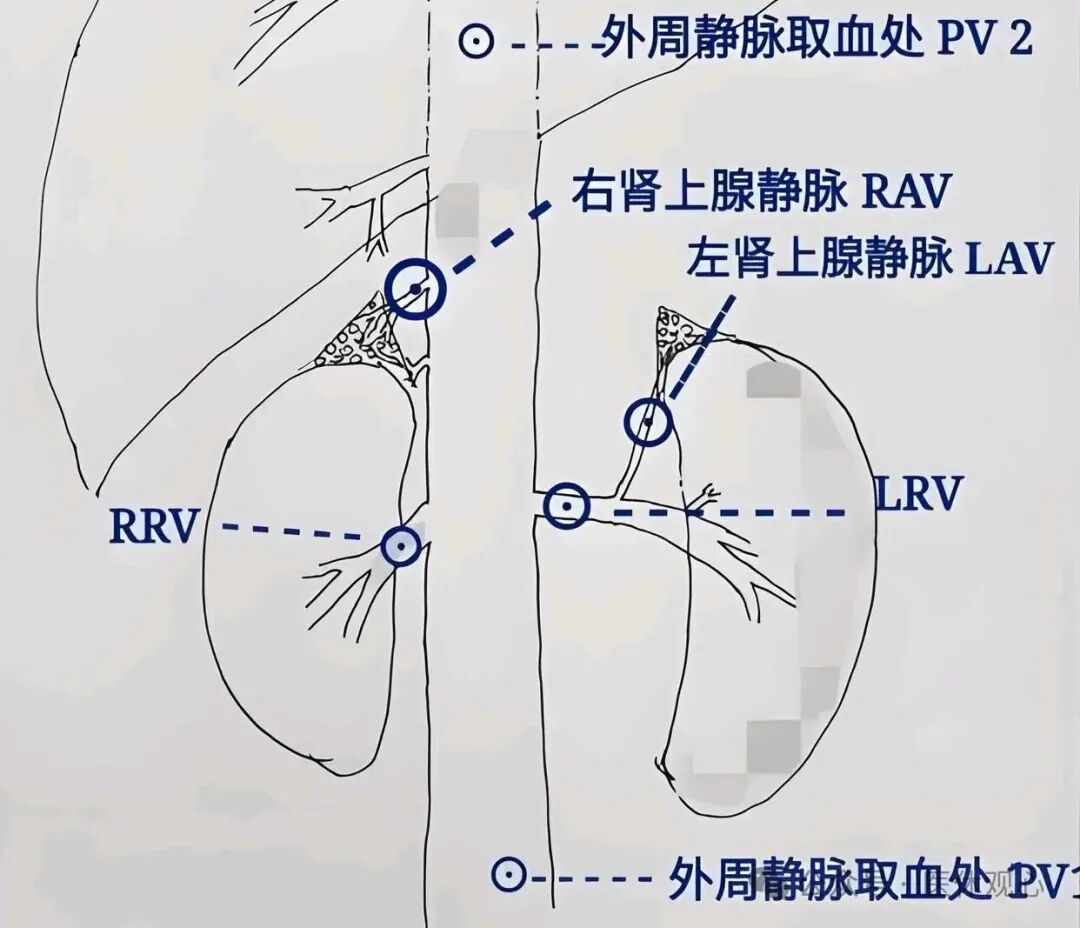
第四关:终极关卡的分型“金标准”之困——难以企及的AVS 为了破解影像学的迷局,我们有“终极武器”——双侧肾上腺静脉采血(AVS)。AVS通过分别抽取左右肾上腺静脉的血液,直接测定醛固酮浓度,是国际公认的区分单侧与双侧病变的最可靠方法,即“金标准”。
然而,这个金标准却面临着两大困境: 技术壁垒高: AVS是一项侵入性、操作极其精细的介入技术。尤其是右侧肾上腺静脉,细小、短促且汇入角度刁钻,成功插管难度极大。这导致AVS的成功率严重依赖于术者的经验和中心的技术水平。国际报道的成功率从30%到96%不等 经验不足的中心失败率很高。 可及性差: 由于技术要求高、开展难度大,目前国内能够常规且高质量开展AVS的中心数量有限,主要集中在大型教学医院。这意味着大量基层和非中心的患者根本没有机会接受这项检查,分型诊断只能退而求其次依赖不甚准确的CT,为后续的治疗决策埋下了巨大的隐患。
三、 超越技术:系统性与认知层面的双重壁垒
除了上述技术层面的重重关卡,医生和医疗系统层面的认知与实践壁垒,也是原醛症被大量漏诊的深层原因。 诊疗惯性与知识更新滞后: 在长期的临床实践中,“原发性高血压”占90%以上的观念根深蒂固,导致了强大的诊疗惯性。许多非专科医生对原醛症的认识仍停留在“高血压+低血钾”的旧观念上,对其高达10%的真实患病率认识不足,缺乏主动筛查的意识。 诊断流程复杂繁琐: 从停药、采血、进行抑制试验到可能的AVS,原醛症的整个诊断流程耗时、费力且成本较高,劝退了部分医生和患者。 患者教育与认知不足: 大多数高血压患者对继发性高血压,尤其是原醛症知之甚少,认为高血压就是“吃一辈子药”,缺乏寻求病因诊断的动力。
结语:拨开迷雾,让“真凶”无处遁形 原发性醛固酮增多症的错诊与漏诊,是一个由疾病自身特点、诊断技术局限、临床医生认知以及医疗系统等多重因素交织而成的复杂问题。它像一个完美的“隐形杀手”,成功地将自己伪装成最普通的“原发性高血压”,从而逃避了精准打击。 然而,识别并治愈原醛症的意义是巨大的——它不仅意味着部分患者的高血压可以被“治愈”或得到显著改善,更重要的是,通过手术或靶向药物治疗,可以逆转醛固酮对心、脑、肾等靶器官的持续损害,极大地改善患者的远期预后。 面对这一严峻的公共卫生挑战,我们需要临床医生和患者共同努力。只有提高了警惕,规范了流程,我们才能让这个隐藏在近3000万高血压患者中的“真凶”无处遁形,为他们带来治愈的希望。
本文2025-12-09 10:35:31发表“医休观点”栏目。
本文链接:https://www.yixiuqixie.com/article/880.html